医用口罩的分类与出关要求;如何区分医用与非医用口罩?
相对于普通的口罩,医用口罩的过滤效果更为显著,尤其是在过滤微小带病毒气溶胶以及有害微尘两方面,效果十分良好,加上其制作材料无毒无害佩戴舒适,因此医用口罩成为了许多人的首选口罩。但是,你了解医用口罩吗?你知道医用口罩都有哪些分类吗?

医用口罩的分类
1、一次性医用口罩
2、医用外科口罩
医用防护口罩
北京海关口罩的出关要求
非医用出口要求
1. 生产厂家营业执照
2. 承诺书(承诺书需要发货人圆公章,尽量扫描原件)
3. 非医疗声明(发货单位需要盖圆公章,尽量清晰,否则有退单补传风险)
4. 发票
5. 箱单
6. 合同
7. 报关委托书
8. 欧盟国家认可的CE认证等。
9. 产品批次号
10. 产品检验报告
11. 产品说明书
12. 合格证(实际货物上每一箱都要放一张,带章)
13. (非医用)呼吸防护用品GB2626-2006
除了提供全面所需文件外,包装也有了具体要求。


医用出口要求
出口医用口罩等医疗器械时需要向海关提供:
1. 生产厂家营业执照
2. 目的国的认证证书(CE/FDA等)
3. 产品说明书
4. 检测报告(CMA/CNAS)及合格证(实际货物上每一箱都要放一张,带章)
5. 产品批次/号
6. 《医疗企业经营备案凭证》
7. 《医疗器械生产企业许可证》
8. 发票
9. 箱单
10. 合同
11. 报关委托书
12. 承诺书(承诺书需要发货人圆公章,尽量扫描原件)
13. 出口医疗物资声明(见附件)
14. 医疗器械产品注册证书
PS:如果是出口新冠病毒检测试剂须提供药监部门出具的出口销售证明。
查验认定医用的标准(仅供参考)
欧洲执行标准分类:
EN-149 民用
EN-143 民用
EN-14683 医用
国内执行标准:
包装出现医用(MEDICAIL)字眼 医用
企业是出口医疗物资质量安全第一责任人,海关依法实施检验监管。出口属于掺杂掺假、以假充真、以次充好的商品或者以不合格进出口商品冒充合格进出口商品的,将依法依规严厉查处;构成犯罪的,依法追究刑事责任。
以上信息仅供参考,希望大家都能够按照海关要求提供资质正确出口。
如何区分医用与非医用口罩?
由于国外新冠肺炎持续爆发,对口罩等防疫物质需求大增,由于各国标准不同,我国出口非医用口罩误作医用的情况时有发生。3月31日,商务部会同海关总署、药监局发布《关于有序开展医疗物资出口的公告》(2020年第5号),要求出口医用口罩等5类产品必须取得国家药品监管部门相关资质,符合进口国(地区)质量标准要求。
那么,究竟如何快速准确地区分医用与非医用口罩呢?海外国家和地区对医疗器械降低或免除进口关税有哪些具体措施?一起来了解。
1
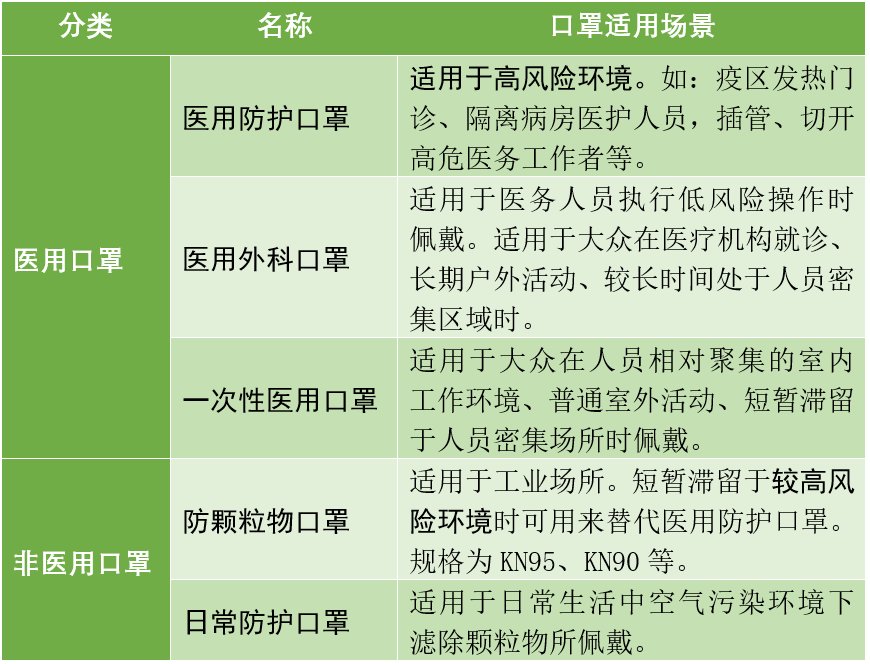
口罩的基本分类与细分
口罩从用途可以分为医用/非医用两大类。顾名思义,医用口罩主要用于医疗方面的防护,可以细分为医用防护、医用外科、一次性医用三种;非医用口罩也被称为个人防护口罩,可根据其适用场景,可细分为防颗粒物和日常防护两种。不同用途的口罩其技术要求不同、适用范围也不同。
2
利用外观与包装信息区分医用/非医用口罩
通过过滤阀分辨。带过滤阀的口罩一般不会是医用口罩。如中国医用防护口罩标准GB 19803-2010 第4.3条款就明确规定“口罩不应有呼气阀”,这样可避免飞沫、微生物等通过呼气阀呼出,从而危害他人。而民用口罩允许有呼气阀,通过呼气阀可以减小呼气阻力,从而有利于作业人员长时间工作。

正规途径销售的口罩产品的最小单元包装上应该有商品名称、执行的标准和防护等级等信息。这些商家明示的信息可以作为一个分辨点,如商品名称中带有“医用”或英文“surgical”“Medical”等字样的,一般可判定为医用口罩。

3
适用标准区分医用/非医用口罩
医用口罩在不同国家/地区适用不同的标准和认证要求,企业和个人可根据产品进口国家/地区,根据产品的适用标准进行区分,产品适用标准和认证信息可从产品外包装或生产者提供的检测报告或证书获得。
医用口罩在美国属于医疗器械,适用《医用口罩材料性能标准规范》(ASTM F2100),由美国食品药品监督管理局(FDA)管理,须通过501K注册或近期FDA公布的其它途径,获得工厂注册和医疗器械列名后方可在美国上市。因此,输往美国的口罩外包装或检测报告或证书上有上述内容的,可被判定为医用口罩。
出口美国非医用口罩不属2020年第5号公告范围,但企业应注意,产品需通过NIOSH注册方可在美国上市。

欧盟医用/非医用口罩均需加贴CE标志,但适用标准不同。
医用口罩在欧盟属于I类器械,分为I类非无菌和无菌两种,需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)加贴CE标志,对应的标准是EN14683,输往欧盟的口罩外包装或检测报告、证书上有上述内容的,可被判定为医用口罩。

需要注意的是,根据口罩无菌/非无菌状态,欧盟采取不同的合格评定办法,非无菌医用口罩企业只需进行CE自我符合性声明,不需要通过公告机构认证。在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。无菌医用口罩还必须由授权公告机构进行CE认证。
出口欧盟非医用口罩不属于医疗器械,但需符合欧盟个人防护设备条例EU2016/425(PPE)要求,由授权公告机构进行CE认证并颁发证书,对应的标准是EN149。
输往其它国家和地区口罩产品,可参考其提供的中国标准检测证书与注册备案信息进行判断,中国医用口罩标准有三个,GB 19083-2010、YY 0469-2011、YY/T 0969-2013,使用这三个标准生产的口罩可被判定为医用口罩。

4
通过政府注册管控信息进行区分
由于医用口罩在大部分国家或地区都是按照医疗器械进行注册或管控的,消费者可以进一步通过相关注册管控信息进行分辨。下面以中、美、欧三个国家和地区举例分析。
医用口罩在中国属于二类医疗器械,是由省一级药品监管部门实施注册管理,可以通过医疗器械查询医疗器械准入号进行查询。链接为:
http://www.nmpa.gov.cn/WS04/CL2590/
已获得美国FDA准入的口罩产品可以通过其官网查询注册证书号进行查询,链接为:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm
另外根据FDA最新政策,目前是在满足一定条件的情况下认可中国标准的口罩,其授权企业的链接为:
https://www.fda.gov/media/136663/download
出口欧盟医用口罩可通过获得授权的公告机构进行查询,其中欧盟医疗器械指令93/42/EEC(MDD)授权的公告机构查询地址为:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
欧盟医疗器械条例EU 2017/745(MDR)授权的公告机构查询地址为:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
海关总署商检司将不定期更新部分国家或地区防疫物资技术法规和标准,目前已更新至第三版,链接为:
http://sjs.customs.gov.cn/sjs/zcfg56/2951967/index.html
(来源:海运网)





































